Apesar de o modelo ondulatório da luz explicar muitos aspectos de seu comportamento, existem vários fenômenos que ele não pode explicar. Três desses são especialmente pertinentes para o entendimento de como a radiação eletromagnética e os átomos interagem. Esses três fenômenos são (1) a emissão de luz por projetos quentes (chamada radiação de corpo preto porque os objetos estudados parecem preto antes do aquecimento), (2) a emissão de elétrons a partir de uma superfície metálica onde a luz incide (o efeito fotoelétrico) e (3) a emissão de luz a partir de átomos de gás excitados eletricamente (espectros de emissão).
Objetos quentes e quantização de energia
Quando os sólidos são aquecidos, eles emitem radiação, como visto na incandescência vermelha das trempes de um fogão elétrico e a luz branca brilhante de lâmpadas de tungstênio. A distribuição do comprimento de onda de uma radiação depende da temperatura, um objeto "vermelho quente" que é mais frio do que um objeto "quente branco". No final do século XIX alguns físicos estudavam esse fenômeno, tentando entender a relação entre a temperatura e a intensidade e os comprimentos de onda da radiação emitida. As leis predominantes da física não podiam explicar essas observações.
Em 1900, um físico alemão chamado Max Planck (1858 - 1947) resolveu o problema fazendo uma suposição audaciosa: ele propôs que a energia podia ser liberada (ou absorvida) por átomos apenas em "pedaços" distintos de tamanhos mínimos. Planck deu o nome quantum (significando "quantidade fixa") para a menor quantidade de energia que podia ser emitida ou absorvida como radiação eletromagnética. Ele considerou que a energia, E, de um único quantum é igual a constante multiplicada pela frequência.
Max Planck
A constante "h", conhecida como constante de Planck, tem valor de 6,33 x 10^-34 joule segundos (j s). De acordo com a teoria de Planck, a energia é sempre emitida ou absorvida pela matéria em múltiplos inteiros de hv, 2hv, 3hv e assim por diante. Se a quantidade de energia emitida por um átomo for 3hr, por exemplo, dizemos que foram emitidas 3 quanta de energia.
Se a noção de energia quantizada lhe parece estranha, pode ser útil fazer uma comparação entre uma rampa e uma escada. À medida que você sobe uma rampa, sua energia potencial aumenta uniformemente, de maneira contínua. Quando você sobe uma escada, você pode pisar apenas em degraus individuais, não entre eles, de modo que sua energia potencial está restrita a determinados valores e, portanto, é quantizada.
O efeito fotoelétrico e fótons
Poucos anos após Planck apresentar sua teoria, os cientistas começaram a ver a sua aplicabilidade para um grande número de observações experimentais. Em 1905, Abert Einstein (1879 - 1955) usou a teoria quântica de Planck para explicar o efeito fotoelétrico.
Abert Einstein
Para explicar este efeito Einstein supôs que a energia radiante atingindo a superfície metálica é um fluxo de pacotes minúsculos de energia. Cada pacote, chamado fóton, comporta-se como uma partícula minúscula. Ampliando a teoria quântica de Planck, Einstein deduziu que cada fóton deveria ter uma energia proporcional à frequência da luz: E = hv. Portanto, a própria energia radiante é quantizada.
Energia do fóton = E = hv
Para entender melhor o que é um fóton, imagine que você tem uma fonte de luz que produz radiação com um único comprimento de onda. Suponha também que você pode ligar e desligar a luz cada vez mais rapidamente de modo a fornecer manifestações repentinas e contínuas de energia. A teoria de fótons de Einstein nos diz que eventualmente você atingiria a menor manifestação repentina de energia, dada por E = hv. A menor manifestação de energia consiste em um único fóton de luz.
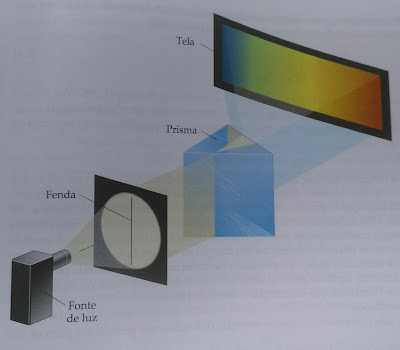
A ideia de que a energia da luz depende de sua frequência ajuda-nos a entender os diversos efeitos que os diferentes tipos de radiação eletromagnética causam à matéria. Por exemplo, altas frequências (comprimentos de onda curto) de raio X (Figura 1) fazem com que os fótons desse tipo tenham alta energia, suficientes para causar danos aos tecidos e até mesmo câncer.
Figura 1. Tipos de comprimentos de onda
A luz possui propriedades de onda e partícula. Comporta-se macroscopicamente como uma onda, mas consiste em um conjunto de fótons. Quando examinamos o fenômeno em um nível atômico, observamos suas propriedades de partículas.